1,7K
Una pila almacena energía química y libera energía eléctrica. Pero, ¿cómo funciona exactamente? Aquí se lo explicamos.
Construcción de una pila
Para entender mejor cómo funciona una pila, a continuación le explicamos brevemente su construcción. El tipo más común es la llamada pila alcalina de manganeso, cuya estructura y funcionamiento te explicamos en este artículo a modo de ejemplo.
- Una pila consta de una o más celdas galvánicas, es decir, celdas que pueden almacenar energía química y liberar energía eléctrica.
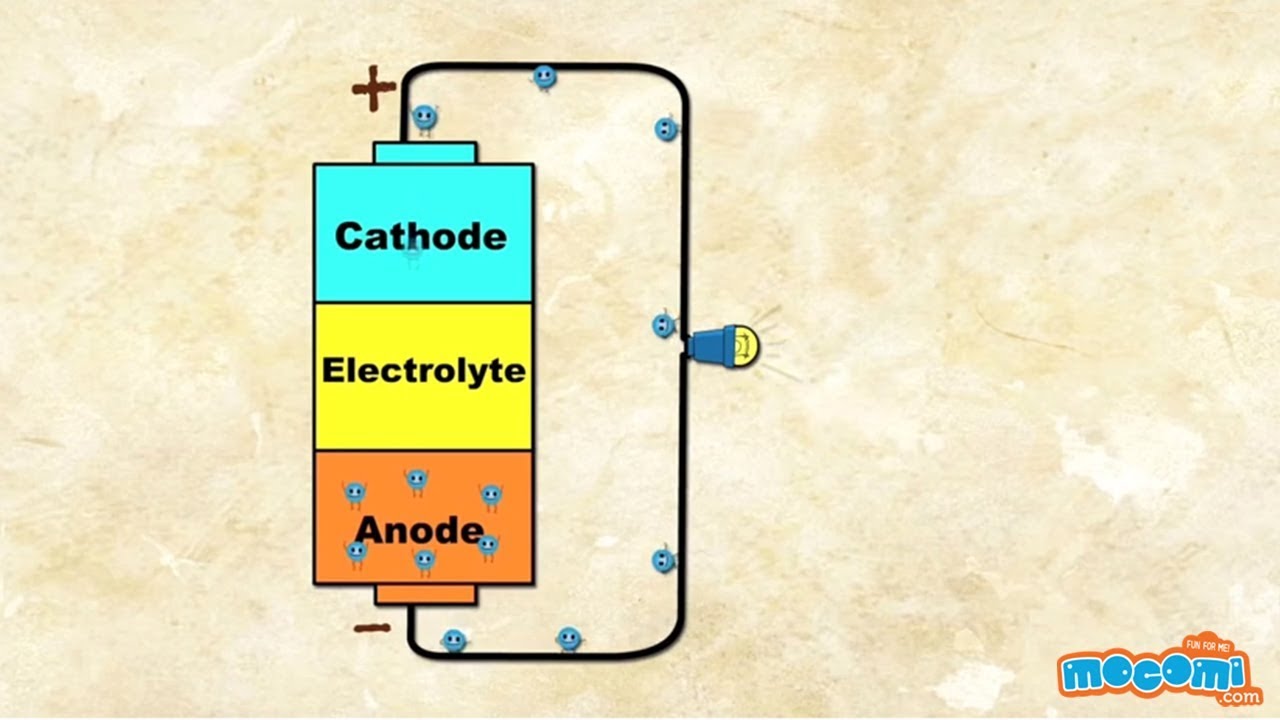
- La pila está encerrada en una carcasa metálica que actúa como terminal positivo. La parte inferior de la carcasa está abierta por el momento.
- En el borde de la pila está el manganeso, que es el electrodo positivo, también llamado cátodo.
- Ambas zonas, cátodo y ánodo, se impregnan con una solución de potasa cáustica. Forma un electrolito que mejora la conductividad de los materiales.
- En la masa de zinc del centro de la pila hay un pasador metálico que hace contacto con una placa metálica en la parte inferior.
- La placa metálica de la parte inferior forma el borne negativo y cierra la pila por abajo. Está separada del terminal positivo y del cátodo por un aislante.
Función de una pila
Cuando se inserta una pila en un aparato, se crea un circuito. Por ejemplo, cuando se conecta una bombilla, los electrones fluyen desde el terminal negativo a través del filamento hasta el terminal positivo. Pero, ¿por qué ocurre esto?
- El zinc es un metal que los químicos llaman metal base. Tiende a ceder electrones.
- El manganeso, por otro lado, es un metal noble, acepta electrones.
- Cuando las dos zonas, cátodo y ánodo, están conectadas entre sí, el zinc, que está empapado en solución de potasa cáustica, cede electrones al manganeso a través del conductor.
- Los electrones en la masa de zinc se producen por una reacción del zinc con la solución de potasa cáustica para formar hidróxido de zinc y dos electrones.
- El hidróxido de zinc se oxida a continuación a óxido de zinc y agua.
- La pila está vacía cuando todo el zinc se ha oxidado con la potasa cáustica a óxido de zinc y agua y ha cedido todos los electrones libres.